概要
環境に調和した有機合成反応を開発することは、持続可能な社会を実現するための基盤となる重要な研究課題です。当研究室では、主に遷移金属錯体を触媒に用い、環境負荷の低い有機合成反応の開発に向けて研究を行っています。特にアルケンなどの炭化水素類や飽和カルボン酸などの再生可能原料を基質として、酸素を利用した酸化反応を開発しています。それらの反応の触媒となり得る新しい遷移金属錯体の創製と反応性に関する研究も行っています。
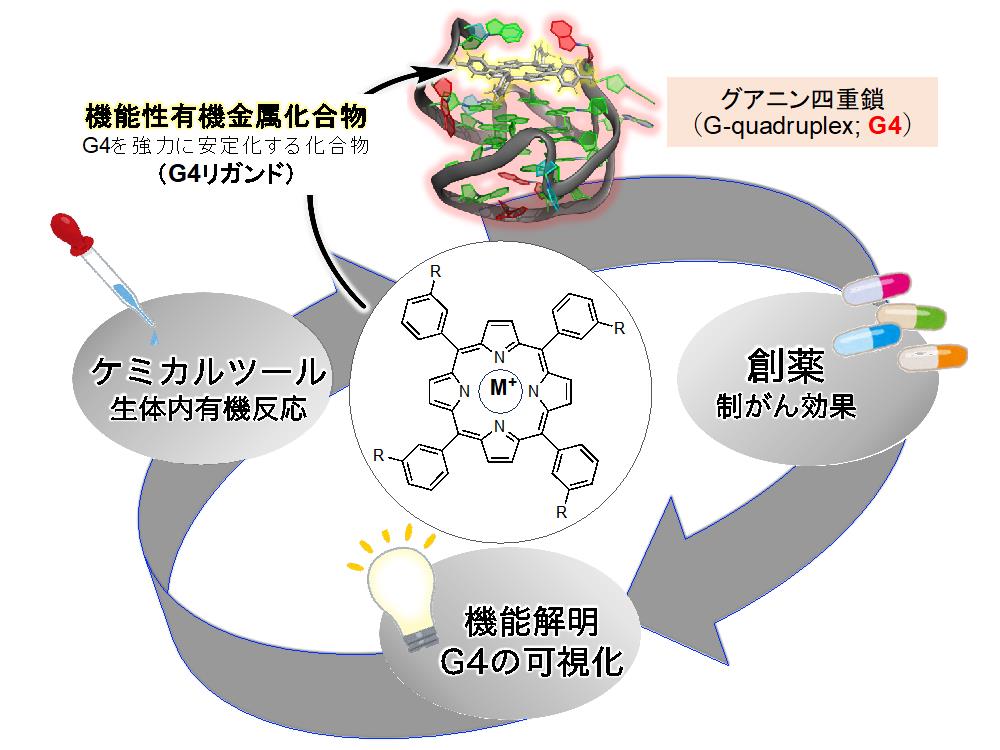
また、核酸(DNAやRNA)の部分構造を標的とした機能性有機金属化合物の開発も進めています。
理学部ウェブサイトの「最新の研究紹介」のページにも研究内容が紹介されています。そちらもご覧ください。
現在進行中の研究テーマ
1. 酸素を用いたアルケン類の触媒的酸化反応の開発
2. 酸素を用いた飽和カルボン酸の触媒的脱水素化反応の開発
3. 触媒的酸素化反応の開発に向けた遷移金属錯体の反応性に関する研究
4. グアニン四重鎖(G4)を標的とした機能性有機金属化合物(G4リガンド)の開発
1.酸素を用いたアルケン類の触媒的酸化反応の開発
1-1. 末端アルケンからのアルデヒドの合成(逆マルコフニコフ型ワッカー型酸化)
酸素を用いて穏和な条件下で末端アルケンの末端炭素側を選択的に酸化できれば、末端アルケンからの効率的なアルデヒド合成法(逆マルコフニコフ型ワッカー型酸化)となり得ます。この合成法は、現行のアルケンからのアルデヒドの工業製法であるヒドロホルミル化(オキソ法)を凌ぎ得る原理的に優れた方法であり、ヒドロホルミル化のように高圧の合成ガス(一酸化炭素と水素の混合ガス)を使用しないため、安全性が高い点が特徴として挙げられます。
私達は、酸化剤として酸素を用いた、パラジウム/銅触媒による芳香族アルケンからのアリールアセトアルデヒド合成反応を見出しました。この反応では、マレイミドなどの環状の電子不足アルケンを少量添加することによって、従来では実現できなかった、常圧の酸素下での反応が実現できました[1-5]。
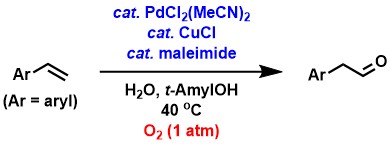
脂肪族末端アルケンからのアルデヒド合成では、パラジウム/銅触媒に加えてp-ベンゾキノン(BQ)を用いることによって、良好なアルデヒド選択性で生成物が得られることがわかりました[4-6]。シンプルな脂肪族末端アルケンからのワッカー型酸化では通常、専らケトンが生成し、アルデヒドはほとんどあるいは全く生成しませんが、私達は上記の触媒系と、アルケンおよび水を反応溶液にゆっくり添加するという方法によって、ケトンに対するアルデヒドの選択性が大幅に向上することを見出しました。
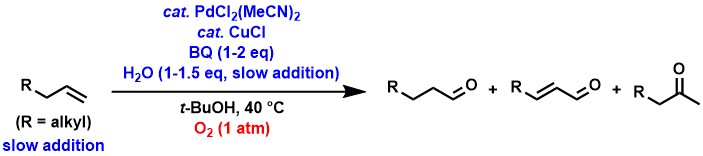
現在は、これらの反応におけるアルデヒド選択性と触媒活性のさらなる向上を目指して研究しています。
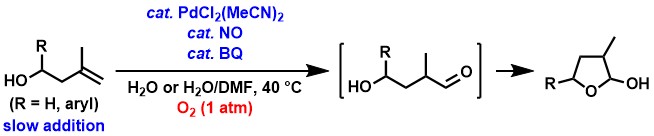
また、かさ高い1,1-二置換アルケンからアルデヒド合成反応が進行することも見出しました[7]。1,1-二置換アルケンからのワッカー型酸化の例はこれまでにごくわずかしか知られていませんが、私達は、3-メチル-3-ブテン-1-オール類を原料として、また、常圧の酸素を酸化剤としてそれぞれ用い、パラジウム錯体/一酸化窒素/BQ触媒系を適用することによって、アルデヒドの生成を経て環状ヘミアセタールが得られることを見出しました。
1-2. 末端アルケンからの末端アセタールの合成(逆マルコフニコフ型酸化的アセタール化)
上記のアルデヒド合成反応に関連する酸化反応として、私達は、末端アルケンからの末端アセタール合成反応も開発しました[2,4,5,8]。末端アセタールはアルデヒドの保護体であり、合成化学的に有用な化合物です。芳香族アルケンやアリルエーテル、1,5-ジエンなどを基質として、酸化剤にBQを用いることで反応が効率的に進行します。
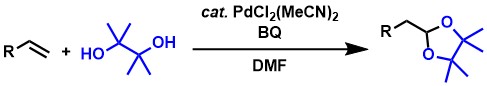
上記のアセタール合成反応をさらに発展させ、酸化剤としてBQに代えて常圧の酸素を利用できる触媒系も見出しました[2,4,5,9] 。この反応では触媒量のメトキシ-p-ベンゾキノン(MeOBQ)の添加が鍵となっています。速度論実験の結果、MeOBQがパラジウムの配位子として働いて反応が加速され、効率的な触媒系となることがわかりました。
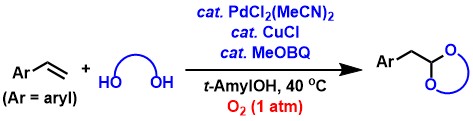
脂肪族末端アルケンからの末端アセタール合成反応は、アルデヒド合成反応の場合と同様に非常に進行しにくい反応です。私達は、脂肪族末端アルケンからのアルデヒド合成反応と類似の反応条件を適用することによって、本反応を効率的に進行させることに成功しました[4,5,10]。
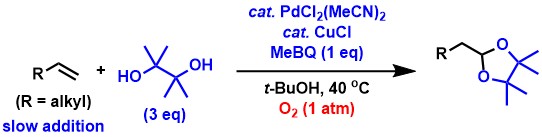
現在は、これらの反応における末端選択性と触媒活性のさらなる向上、および基質適用範囲の拡大を目指して研究しています。
文献
1. Nakaoka, S.; Murakami, Y.; Kataoka, Y.; Ura, Y.*, Maleimide-assisted
Anti-Markovnikov Wacker-type Oxidation of Vinylarenes Using Molecular Oxygen
as a Terminal Oxidant, Chem. Commun. 2016, 52, 335-338.
2. 浦 康之*,パラジウム触媒による酸素を用いた炭化水素類の末端選択的な酸化反応の開発を目指して,有機合成化学協会誌 2018, 76, 1291–1300.
3. 化学工業日報,2017年10月12日付朝刊(中部西日本面).
4. Ura, Y.*, Palladium-Catalyzed Anti-Markovnikov Oxidation of Aromatic
and Aliphatic Alkenes to Terminal Acetals and Aldehydes, Synthesis 2021,
53, 848-860.
5. Ura, Y.*, Realization of Anti-Markovnikov Selectivity in Pd-Catalyzed
Oxidative Acetalization and Wacker-Type Oxidation of Terminal Alkenes,
Chem. Rec. 2021, 21, 3458-3469.
6. Komori, S.; Yamaguchi, Y.; Murakami, Y.; Kataoka, Y.; Ura, Y.*, Palladium/Copper‐catalyzed
Oxidation of Aliphatic Terminal Alkenes to Aldehydes Assisted by p‐Benzoquinone,
ChemCatChem 2020, 12, 3946–3955.
7. Tanaka, R.; Komori, S.; Shimizu, Y.; Kataoka, Y.; Ura, Y.*, Synthesis
of 2-hydroxytetrahydrofurans by Wacker-type oxidation of 1,1-disubstituted
alkenes, Org. Biomol. Chem. 2022, 20, 570–574.
8. Yamamoto, M.; Nakaoka, S.; Ura, Y.*; Kataoka, Y., Palladium-catalyzed
Synthesis of Terminal Acetals via Highly Selective Anti-Markovnikov Nucleophilic
Attack of Pinacol on Vinylarenes, Allyl Ethers, and 1,5-Dienes, Chem. Commun.
2012, 48, 1165-1167.
9. Matsumura, S.; Sato, R.; Nakaoka, S.; Yokotani, W.; Murakami, Y.; Kataoka,
Y.; Ura, Y.*, Palladium-catalyzed Aerobic Synthesis of Terminal Acetals
from Vinylarenes Assisted by pi-Acceptor Ligands, ChemCatChem 2017, 9,
751-757.
10. Komori, S.; Yamaguchi, Y.; Kataoka, Y.; Ura, Y.*, Palladium-catalyzed
Aerobic anti-Markovnikov Oxidation of Aliphatic Alkenes to Terminal Acetals,
J. Org. Chem. 2019, 84, 3093–3099.
2. 酸素を用いた飽和カルボン酸の触媒的脱水素化反応の開発
α,β-不飽和カルボン酸は、共役付加をはじめとする多彩な反応性を示すことから、有機合成における合成中間体として汎用される重要な化合物群です。工業的にも、例えば最もシンプルなα,β-不飽和カルボン酸であるアクリル酸は、ポリアクリル酸ナトリウム(高吸水性ポリマー)やアクリル酸エステル(共重合により塗料や繊維用化学品その他に利用される)などの原料として用いられます。一方、長鎖の飽和カルボン酸は油脂の加水分解によって、また、短鎖の飽和カルボン酸は有機物の微生物による代謝によって、それぞれバイオマスから得られる再生可能な原料です[1]。したがって、α,β-不飽和カルボン酸を飽和カルボン酸から環境低負荷な方法で効率よく合成することが可能となれば、長期的な観点から見てα,β-不飽和カルボン酸の優れた製造法となり得ます。
私達は、酢酸パラジウム/ピリジン触媒系と、安全・安価かつ豊富に存在する酸素を酸化剤として用いることによって、飽和カルボン酸からの脱水素化によるα,β-不飽和カルボン酸合成法を見出しました[2]。プロピオン酸を原料として用いた場合には、対応する脱水素化生成物であるアクリル酸と、アクリル酸にプロピオン酸が共役付加した生成物がそれぞれ得られました。共役付加生成物は加熱によってアクリル酸とプロピオン酸に分解できます。酢酸パラジウムおよびピリジンはいずれも必須であり、非存在下では反応は全く進行しないか、あるいは生成物の得られる量が大きく低下しました。
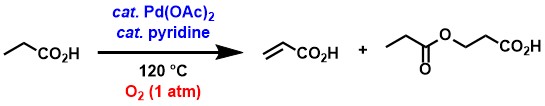
プロピオン酸以外にも、本反応はより長い直鎖状や枝分かれ構造などさまざまな炭化水素鎖をもつ飽和カルボン酸に対して適用することができました。
現在は、触媒活性の飛躍的向上に向けた検討を行っています。
文献
1. 社団法人 日本エネルギー学会編,バイオマスハンドブック 第2版,オーム社,2009.
2. Shibatani, A.; Kataoka, Y.; Ura, Y.*, Palladium-Catalyzed Aerobic α,β-Dehydrogenation
of Carboxylic Acids, Asian J. Org. Chem. 2021, 10, 3285–3289.
3. 触媒的酸素化反応の開発に向けた遷移金属錯体の反応性に関する研究
酸素を酸化剤として用いて、炭化水素からアルコールやアルデヒドなどの含酸素有機化合物を効率的かつ選択的に合成できれば、工業的にも、また、実験室レベルにおいても重要な合成反応となり得ます。
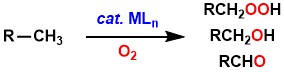
このような触媒的酸素化反応の開発に向けて、当研究室では、炭化水素配位子をもつ遷移金属錯体と酸素との反応性に関する研究を行っています。私達は、ベンジルパラジウム錯体と酸素との量論反応が、n-Bu4NXなどのアニオン源やブレンステッド酸などの添加によって顕著に加速されることを見出しました[1,2]。この反応ではベンジル配位子由来の酸素化生成物(ベンズアルデヒド、ベンジルヒドロペルオキシド、ベンジルアルコール)が得られます。プロトンの存在/非存在によって主生成物が変化し、反応機構も変化することが示唆されました。
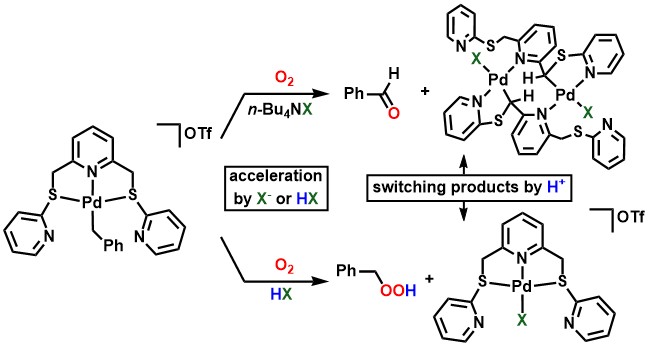
プロトンの存在がベンジル配位子の酸素化を加速するという結果を受けて、ブレンステッド酸部位を金属原子の近くに配置することによって酸素化をさらに加速できるのではないかと考え、そのような配位子として第二級ホスフィンオキシド
(secondary phosphine oxide, SPO) に着目しました。SPOは亜ホスフィン酸と互変異性体の関係にあり、亜ホスフィン酸はリン原子で金属に配位して、そのすぐ隣にブレンステッド酸部位を配置できます。
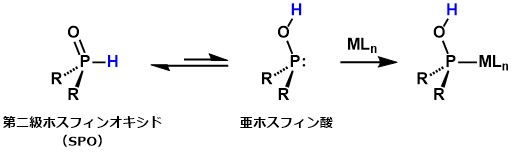
酸素雰囲気下、ベンジルパラジウム錯体 [PdBn(Cl)(cod)] (cod = 1,5-cyclooctadiene) に対してSPOとしてジフェニルホスフィンオキシドを反応させたところ、ベンジル配位子の酸素化が室温、30分で速やかに進行してベンジルヒドロペルオキシドが高収率で生成しました[3]。SPO非存在下ではベンジル配位子の酸素化は全く進行しなかったことから、SPOが酸素化を加速していることがわかります。また、酸素の量を少量(錯体に対して0.5当量)に減らして同様の反応を行ったところ、ベンジルヒドロペルオキシドではなくベンジルアルコールが選択的に生成しました[3]。
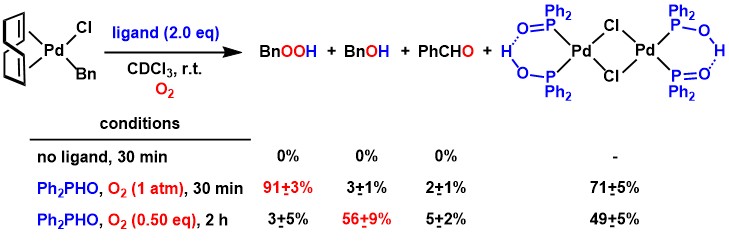
さらに幾つかの実験結果をふまえ、この反応では、亜ホスフィン酸配位部位のプロトンがパラジウムと酸素との反応を以下のように促進しているものと考えています。
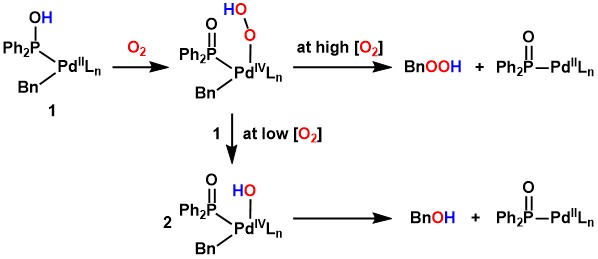
ベンジル配位子などの炭化水素配位子の酸素化は、困難な炭化水素類の触媒的酸素化反応を実現するための鍵段階と捉えることができ、上述の成果は、そのような触媒反応の実現に向けた重要な知見となるものと考えられます[1-4]。
現在は酸素化についてのより詳細な反応機構を調べるとともに、炭化水素類の触媒的酸素化反応の開発を目指して研究を進めています。
文献
1. 浦 康之,パラジウム触媒による酸素を用いた炭化水素類の末端選択的な酸化反応の開発を目指して,有機合成化学協会誌 2018, 76, 1291–1300.
2. Shimokawa, R.; Kawada, Y.; Hayashi, M.; Kataoka, Y.; Ura, Y.*, Oxygenation
of a Benzyl Ligand in SNS-Palladium Complexes with O2: Acceleration by
Anions or Brønsted Acids, Dalton Trans. 2016, 45, 16112–16116.
3. Oka, S.; Shigehiro, Y.; Kataoka, Y.; Ura, Y.*, Secondary Phosphine Oxide-triggered
Selective Oxygenation of a Benzyl Ligand on Palladium, Chem. Commun. 2020,
56, 12977–12980.
4. Shigehiro, Y.; Miya, K.; Shibai, R.; Kataoka, Y.; Ura, Y.*, Synthesis
of Pd-NNP Phosphoryl Mononuclear and Phosphinous Acid-Phosphoryl-Bridged
Dinuclear Complexes and Ambient Light-Promoted Oxygenation of Benzyl Ligands,
Organometallics 2022, 41, 2810–2821.
4. グアニン四重鎖(G4)を標的とした機能性有機金属化合物(G4リガンド)の開発
私たちの体は、核酸(DNAやRNA)によって保持される遺伝情報に基づいて構築され、生命活動を維持しています。そのため、核酸は「生命の設計図」とみなされ、その配列情報(A,
T, C, G, U) が重要であると考えられてきました。しかし近年の研究では、核酸がその配列情報に加えて特有の高次構造を形成し、これが生命現象における重要な調節機能を果たしていることが明らかになってきました。その代表的な高次構造として、グアニン四重鎖(G4)というグアニンを豊富に含む配列により形成される特殊な構造があります。G4は体内で広く存在し、その形成や安定化ががん細胞のアポトーシス誘導や遺伝子発現の調節に関与することが判明しました。最近では、G4の安定化がコロナウイルスゲノムの複製や転写を阻害し、コロナウイルス感染症を緩和することが報告されました。このような背景から、G4は「新たな生命現象の制御因子」と考えられ、G4の形成や安定化を促す低分子化合物
(G4リガンド) は「創薬シーズ」や「分子プローブ」として期待されています。
当研究室では、このG4を標的とした機能性有機金属化合物(G4リガンド)の開発を行っています。このリガンドを活用し、G4関連の疾患治療やG4を起点とした生体内化学反応、標的分子の選択的な可視化等の応用を目指します。