|
奈良女子大学
藤井研究室
|
生体内の金属酵素は、十数種類の金属イオンしか用いないのに、非常に多くの生体反応を可能にしています。私たちは、この多様性を支配する鍵は、酵素反応中
間体にあると考えています。金属酵素は、反応中間体の構造や反応性を金属イオンとタンパク質の共同作業により制御し、多くの反応を可能にしていると考えま
す。金属酵素の機能発現の分子機構を反応中間体をキーワードに研究しています。そしてその研究成果から、既存の酵素の機能変換法や我々が必要とする機能を
もつ高機能・高選択的金属錯体触媒、さらには人工酵素の開発をめざしてます。
酸
素活性化を行う金属酵素の機能発現機構の解明
|
私たちの体の中で働く多くの金属酵素は、呼吸から取り入れた酸素分子を活性化して様々な反応に利用しています。活性化された酸素分子の多様な反応性や選択
性は、いかにして制御されているのか?この問題を解明するする鍵は、酵素反応中に生成する高原子価状態の反応中間体の構造、電子構造、反応性にあると考え
ます。藤井研究室では、このような高原子価酵素反応中間体の電子構造や反応性、反応性制御機構などを酵素やその変異体、酵素活性部位モデル金属錯体などを
用いて研究しています。
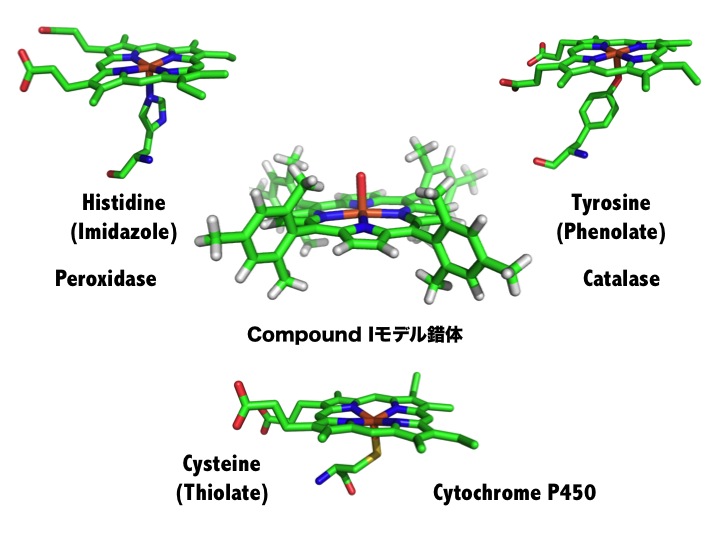
チトクロームP450、ペルオキシダーゼ、カタラーゼは、酸化反応を触媒するヘム(鉄ポルフィリン錯体)を活性部位にもつ金属酵素です。これらの酵素はど
れも、Compound
Iと呼ばれる鉄4価オキソポルフィリンπカチオンラジカル状態の高原子価反応中間体を酸化反応活性種として生成します。しかし、これらのCompound
Iはまったく異なった反応性を示します。酵素は、どのようにCompound Iの反応性を制御しているのでしょうか?我々は、Compound
Iのモデル金属錯体を合成し、それに様々な構造変化を導入することにより、Compound Iの構造、電子構造と反応性に関わりを研究しています。
最近の研究
成果
|
|
チトクロームP450、ペルオキシダーゼ、カタラーゼは、システイン(チオレート)、ヒスチジン(イミダゾール)、チロシン(フェノレート)がヘムに結合
するアミノ酸由来の配位子であることが知られている。これらの構造は、酵素特有であるため機能と関わりがあると考えられてきた。我々は、Compound
Iモデル錯体にイミダゾールやフェノレートを導入することに成功し、これらの配位子がCompound
Iの反応性を著しく増加させていることを明らかにした。つまり、これら酵素の配位子は、酵素の高い活性を維持するための重要な因子であることを示した。
|
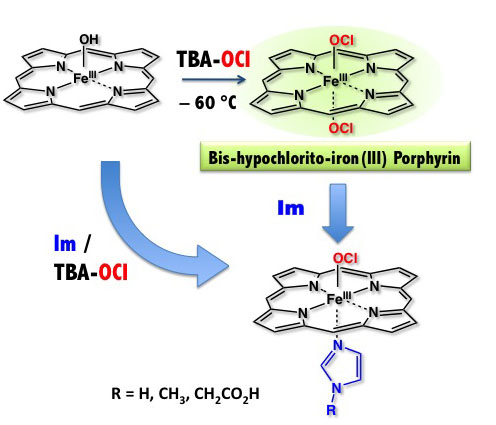
我々の体内に侵入した細菌は、血液中の白血球が分解します。白血球(好中球)は、細菌と戦うために活性酸素や次亜塩素酸を酸素分子を使って合成します。次
亜塩素酸は、好中球の中のミエロペルオキシダーゼ(MPO)により合成されます。我々は、MPOが次亜塩素酸を合成する反応機構、反応中間体などを研究し
ています。
最近の研
究成果
|
|
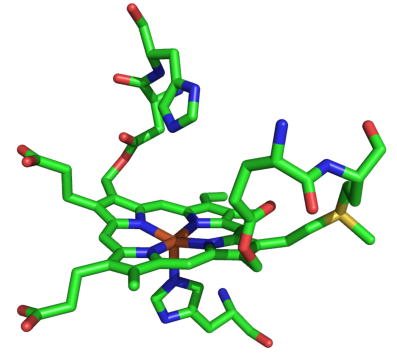
MPOの活性部位の構造
|
MPOが次亜塩素酸を合成する過程で生成する鉄3価ヘム次亜塩素酸付加錯体のモデル錯体の合成に初めて成功しました。この錯体は、たいへん不安定な錯体で
あるためこれまでに同定されたことがない錯体です。私たちの研究室では、世界で初めてこの錯体の同定に成功しました。この錯体を研究すると、塩素化反応や
エポキシ化
反応を引き起こすことができる錯体であることがわかりました。またたいへん不安定で、–40度でも数分で分解して鉄4価オキソヘム錯体になりました。酵素
反応中では検出不可能な状態でも、モデル化によりその電子構造や反応性が明らかになっていきます。
|
窒
素循環サイクルに関わる金属酵素の研究
|
地球の大気は、主に窒素と酸素からなります。我々を含む地球上の多くの生物は、酸素を利用して生命を維持しています。一方、酸素が存在しないような環境で
生活する細菌類の中には、窒素酸化物、アンモニアなどを利用して生きているものもいます。これらの生物は、図に示すような窒素化合物の地球上での循環サイ
クルを形成しています。このサイクルは、地球の環境を維持するためになくてはならないものです。我々の生活環境もこれらの微生物によって支えられているの
です。このサイクルを回しているのは、微生物の中の金属酵素です。我々は、これらの金属酵素がどのようにして反応しているのかを研究しています。
最
近の研
究成果
|
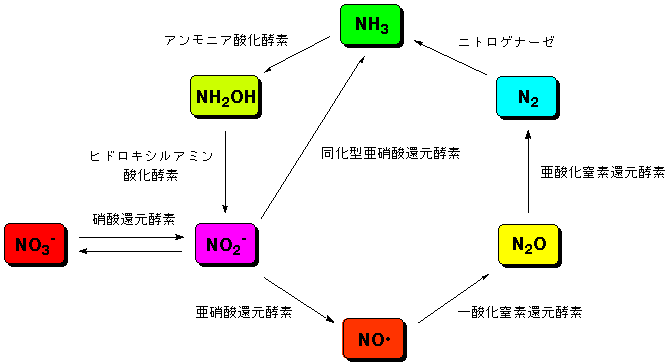
地球上での窒素循環サイクルとそれに関わる金属酵素
|
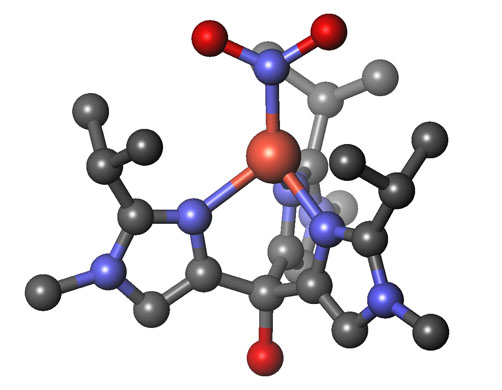
我々は、左図のサイクルの中の亜硝酸
還元酵素の研
究を行いました。その結果、亜硝酸還元酵素の酵素反応中間体のモデル化合物の合成、構造解析に成功しました。この錯体は、酵素反応中では同定できない不安
定な錯体です。さらにそれらモデル錯体を用いて、酵素の高い反応活性がアミノ
酸由来のヒスチジン配位子にあることを世界で初めてつきとめました。これにより、亜硝酸還元酵素がなぜ固有の反応環境を必要とするのかが明らかになりまし
た。
|
|
不
斉マンガンサレン錯体による不斉エポキシ化反応の活性種の同定
|
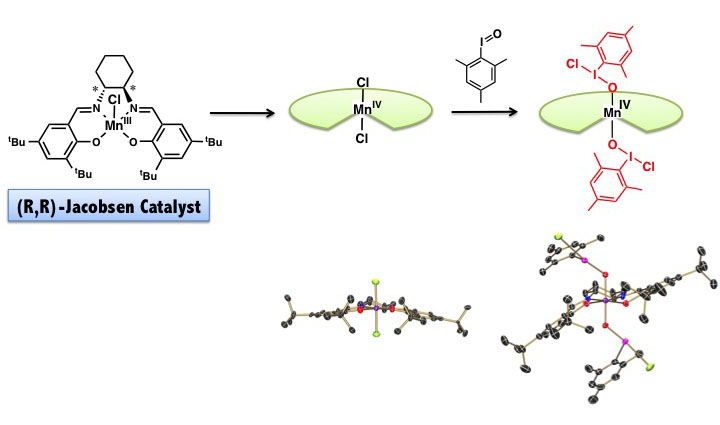
シクロヘキサン環をもつ不斉なマンガンサレン錯体は、Jacobsen触媒と呼ばれ高い不斉収率でオレフィンをエポキシ化します。この触媒がどのようして
不斉を認識して、またどのような活性種がエポキシ化しているのかは、未解明の課題です。我々の研究室では、不斉マンガンサレン錯体の不斉エポキシ化機構を
解明めざし研究を行っています。
最
近の研究成果
|
|
Jacobsen触媒は、ほとんど平面的な構造をしています(中央下の構造を見てください)。これではオレフィンの面を認識するのは極めて困難なように思
われます。我々は、Jacobsen触媒からマンガン4価ジクロロ錯体を合成し、さらにこれからヨードシルアレンが付加したマンガン4価ヨードシルアレン
付加錯体の合成、単離、構造解析に成功しました。構造解析の結果、マンガンサレン配位子が大きく階段状にねじれ、不斉な環境をマンガンイオン周辺に作り出
していることがわかります。ヨードソアレンが金属錯体に配位した構造は、これにより世界で初めて解明されました。この錯体は、良好な不斉収率でオレフィン
をエポキシに変換することができました。
|
|







