生物無機化学研究室
3 |体の中で働く金属イオンと酵素の仕組みの解明
私たちの体の中にはたくさんの金属イオンを活性部位に含むタンパク質が存在し、私たちの生命活動を支えています。これらのタンパク質は、金属タンパク質や金属酵素と呼ばれ、活性部位の金属イオンが機能と直接関係しています。例えば、体の中の鉄分が足りなくなると貧血を起こすのも、金属酵素(タンパク質)の関与するところです。私たちが必要とする金属イオンは、鉄、銅などわずか十数種類ですが、金属酵素が行う反応の種類は莫大な数になります。どうしてわずかな金属イオンからこんなにたくさんの種類の反応ができるようになるのでしょうか?私たちの研究グループでは、この問題に答えるため金属酵素の機能がどのような機構で発現されているのかを、錯体化学的手法、生化学的手法、分光学的手法を駆使して分子レベルで解明することをめざしています。
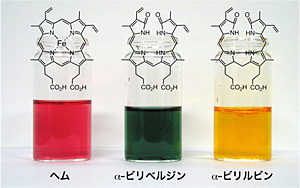
図1 私たちの血液(赤血球)は、約120日で新陳代謝されます。この時、赤血球中のヘモグロビン中のヘムは、肝臓や脾臓でヘムオキシゲナーゼという酵素により分解されます。上の写真は、生体内でヘムが分解される様子を示しています。赤いヘムは、ヘムオキシゲナーゼにより緑色のα-ビリベルジンという物質に分解され、最終的に黄色のα-ビリルビンになります。この黄色は、尿や便の色になります。黄色の尿や便は、血液が新陳代謝された証です。
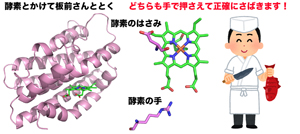
図2 ヘムオキシゲナーゼ(図左)はいったいどのようにヘムを分解するのでしょうか?私たちはこの問題に挑みました。その結果、ヘムオキシゲナーゼにある2つの重要なアミノ酸残基が酵素の手やはさみののように巧みに働く機構が解明されました。酵素が働く様子は、まるで腕のよい板前さんのようです。
4 |金属蛋白質の設計と光機能発現
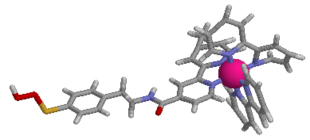
生体内では光合成を始めとした光を利用する幾つもの段階的な電子移動、エネルギー移動反応が進行しており、蛋白質・酵素がそれらの複雑な系における中心的な役割を担っています。私たちの研究室では、重要な化学反応である光誘起電子移動反応に着目し、モデル系を利用した複雑な生体内反応の素過程解明や、人工金属蛋白質の開発による光機能発現を目的とした研究を合成化学的手法を駆使して行っています。これまで主として、図1に示した蛋白質の活性中心に金属錯体(ヘム)を含むヘム蛋白質やDNAで起こる光電子移動反応機構の解明などについてレーザー光を用いた高速時間分解分光測定を実施することにより検討してきました。近年は、光増感作用を有する金属錯体(図2)を基体とした新しい蛋白質-リガンド複合体の構築を行い、新たな光電子移動反応系の開発と機能評価を行っています。